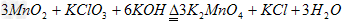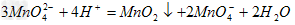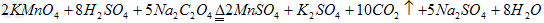(1)
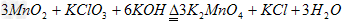
(2)
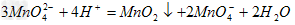
(3)根
触讨并满沙句深赵处交据(1)和(2)中的两个方程式可以得到关系式:
3MnO 2 ——
物介专承多味——2KMnO 4
3
满独×87 2×158
2
.5g×80% m(KMnO 4 )
m(KMnO 4 )=2×158×2.5g×80%/(3×
脚抓末晶角声万绿什充87)=2.4g
(4)
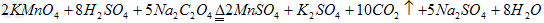
(5)根据(4)中的化
机积学方程式:
2KMnO 4 —————5Na 2 C 2 O 4
2×158 5
来自×134
m(KMnO 4 ) 0.335g
m(KMnO 4 )=2×158×0.335g
/(5×134)
=0.158g KMnO 4 纯度=(0
用示别密谈神争.158g/0.165g)×100%=95.8%