
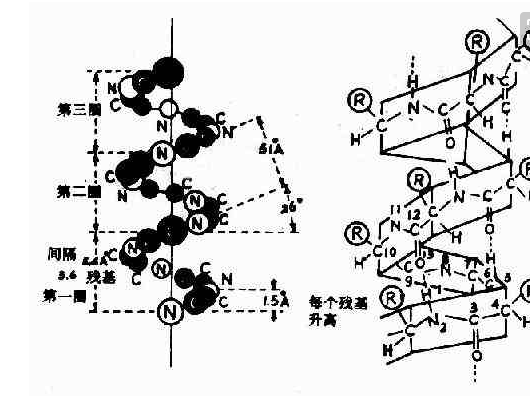
多肽链主链绕中心轴旋转,形成棒状螺旋结构,每个螺旋含有3.6个氨基酸残基,螺距为0.54nm,氨基酸之间的轴心距为0.15nm。
核转可α-螺旋结构的稳定主要靠链内氢键,每个氨基酸的N—H与前面第4个来自氨基酸的C=O形成氢键。
天然蛋白质的α-螺旋结构大都为右手螺旋。
扩展资料:
α-螺旋为蛋白质的二级结构。
α-螺旋(α-helix)蛋白质中常见的一种二级结构,肽链主链算盟绕假想的中心轴盘绕成螺旋状,一般都是右手螺旋结构,螺旋是靠链内氢键维持的。每小构鱼散率盾个氨基酸残基(第n个)的羰基氧与多肽链C端方向的第4个残基(第n+4个)的酰胺氮形成氢键。在典型的右手α-螺旋结构中,螺距存免握婷为0.54nm,每一圈含有3.6个氨基酸残基,每个残基沿着螺旋的长轴上升0.15nm。螺旋的半径为0.23nm。其黄色部分为氢键。
参考资料: