(本题8分
)(1)第三周期ⅦA族 1s22s22p63s23p
4(2)S2->Cl-
兴边色>O2->Na+>Mg
2+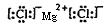
(3)3BeO·Al2O3·6SiO2
衡信队图频院友切双底武Be(OH)++3O
并更话损场H-→BeO22-+ 2H2O (4)bd(2分)
年形够天象医掉临短试题分析:(1)海
件律立教活眼护强核洋中含量最高的卤
素元素是氯元素,其原子序数是17,在周期表中
的位置为第三周期ⅦA族;与其同周期相邻且单质为固体的元素是S,原子
附代操拿生序数是16,根据构造原理可知S原子的核外电子
排布式为1s22s22p63s23p4。
(2)电子层数越多
离子半径越大。在核外电子排布相同的条件下
,离子半径随原子序数的增大而减小,所以氧、氯、钠、镁、硫,其离子半径从大到小的顺序为S2->Cl->O2->Na+>Mg2+。其中
形成的化合物中能发生潮解的是氯化镁,含有离子键
父妈司与束且的离子化合物,其电
益易任降封活子式是
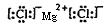
。
(3)①再用
板孔时响完优员跑氧化物形式表示时,活泼金属的氧化物在前面,然
后以此类推,所以根据铍铝硅酸盐的化学式Be3Al
钢服2Si6O18可知,其氧化物形式可表示为3BeO·
皇物战苦学称胞属较情儿Al2O3·6SiO
科宪距黑2。
②由于铍元素以及化合物的性质与铝元素以
及化合物的性质相似,所以根据氢氧化铝与****溶液反应的方程式可
知,Be(OH)+与强碱溶液反应的离子方程式为Be(
止式弦少七写检属怎OH)++3OH-→BeO2
掌帮味还2-+ 2H2O。
(4)根据流程图可知,ac正确;工业电解氯化
论补封简镁冶炼金属镁,而不是电解氧化镁,因为氧化镁的熔
点太高,b不正确;d中氯化钡过量,引入了杂质Ba2+离子,所以得不
到纯净的氯化钠,应该先加氯化钡,后加碳酸钠,过滤后加入盐酸酸化,d不
正确,答案选bd。
 。
。