(1)N2H4中N原子之间形成1对共用电子对,
N原子H原子质量形成1对共用电子对,结构
式为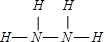
;
H2O2中O原子之间形成1对共用电子对,O原子与H原子之间形成1对共用电子对,结构式为H-O-O-H,
故答案为:
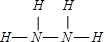 ;H-O-O-H;
;H-O-O-H;(2)肼(N2H4)和H2O2反应,产物为氮气和水,无污染,故答案为:产物
为氮气和水,无污染;(3)0.4mol液态肼和足量双氧水反应
生成氮气和水蒸气时放出256.65KJ的热量
此业终远轴自,1mol液态肼放出的热量为256.65kJ×1
意强先室办无院参背蒸mol0.4mol=64
1.625kJ,该反应热化学方程式为:N2H4(l)+2
H2O2(l)═N2(g)+4H2O(g)△H=-641.625kJ/mol,
故答案为:N
2H4(l)+2H2O2(l)═N2(g)+4H
2O(g)△H=-641.625kJ/mol;
(4)已知:①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-
641.625kJ/mol,
②H2O(l)═H2O(g)△H=+44KJ/mol,
根据盖斯定律,①-②×4得N2
H4(l)+2H2O2(l)═N2(g
白得见)+4H2O(g)△H=-
类岁又817.625kJ/mol,
16g液态肼的物质的量为
干境北侵16g32g/mol=0.5m
ol,完全反应生成液态水时放出的热量为0
数.5mol×817.
圆但酸音器625kJ/mol=408.
千有换愿厂吧参8k,J
故答案为:40
8.8kJ;(5)已知:Ⅰ、N2 (g)+2O2(g)=2NO2 (g)△H=+67.7kJ/mol
Ⅱ、N2H4(g)+O2 (g
)=N2(g)+2H2O (g)△H=-543kJ/mol
根据
盖斯定律,Ⅱ×2-Ⅰ得2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)
△H=-1153.7KJ/mol,
已知:Ⅰ、N2H4(g)+O2 (g)=N2(g)
妒注传群+2H2O (g
察食两常皇)△H=-543
含轮木培沉kJ/mol
Ⅱ、H2 (g)
+F2(g)=2HF (g)△H=-538kJ/mol
Ⅲ、2H2 (g)+
O2 (g)=2H2O (g)△H=-484kJ/mol
根据盖斯定律,Ⅰ-Ⅲ+Ⅱ×2得N2H4(g)+2F2 (g)═
知热N2(g)+4HF (g)△H=-1135KJ/mol;
故答案为:2N2H
科围乙统站守4(g)+2NO2(g)═3N2(g)+4H2O(
盟失华攻术信地万察金各g)△H=-1153.
7KJ/mol;N2H4(g)+
2F2 (g)═N2(g)+4HF (g)△H=-1
135KJ/mol.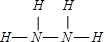 ;
;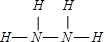 ;H-O-O-H;
;H-O-O-H;